POTENCIALES QUÍMICOS
Potencial químico, cuyo símbolo es μ, es un término introducido en 1876 por el físico estadounidense Willard Gibbs, que él definió como sigue:
«Si suponemos que se añade una cantidad infinitesimal de cualquier sustancia a una masa homogénea cualquiera en un estado de tensión hidrostática, que la masa permanece homogénea y su entropía y volumen permanecen constantes, el incremento de la energía interna de la masa dividida por la cantidad de la sustancia añadida es el potencial para esa sustancia en la masa considerada.»
El potencial químico también se define como la tendencia de un componente a escapar de una determinada fase, así, si el potencial químico es alto, el componente tenderá a salir lo más rápido posible de la fase en que se encuentra y al contrario, si es bajo (incluyendo valores negativos), tenderá a permanecer en ella.
A través del estudio de las interacciones de sustancias homogéneas en contacto, es decir, cuerpos, siendo su composición en parte sólida, en parte líquida, y en parte vapor, y utilizando un gráfico volumen-entropía-energía interna en tres dimensiones, Gibbs pudo determinar tres estados de equilibrio, es decir, "necesariamente estable", "neutral", e "inestable", y si los cambios se producirán o no.
Mientras mayor sea μ, más activa o “dispuesta” al cambio es la sustancia. Mientras más pequeño sea μ, más pasiva o “apática” al cambio es la sustancia.
Gibbs declara:
«Si queremos expresar en una sola ecuación la condición necesaria y suficiente del equilibrio termodinámico para una sustancia cuando se encuentra en un medio a presión P y temperatura T constantes, esta ecuación podría ser escrita:

Donde 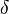 se refiere al cambio producido por cualquier variación en el estado de las partes del cuerpo, y (cuando diferentes partes del cuerpo están en diferentes estados) en la proporción en que el cuerpo está repartido entre los diferentes estados. La condición de equilibrio estable es que el valor de la expresión del paréntesis sea mínima.».
se refiere al cambio producido por cualquier variación en el estado de las partes del cuerpo, y (cuando diferentes partes del cuerpo están en diferentes estados) en la proporción en que el cuerpo está repartido entre los diferentes estados. La condición de equilibrio estable es que el valor de la expresión del paréntesis sea mínima.».
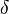 se refiere al cambio producido por cualquier variación en el estado de las partes del cuerpo, y (cuando diferentes partes del cuerpo están en diferentes estados) en la proporción en que el cuerpo está repartido entre los diferentes estados. La condición de equilibrio estable es que el valor de la expresión del paréntesis sea mínima.».
se refiere al cambio producido por cualquier variación en el estado de las partes del cuerpo, y (cuando diferentes partes del cuerpo están en diferentes estados) en la proporción en que el cuerpo está repartido entre los diferentes estados. La condición de equilibrio estable es que el valor de la expresión del paréntesis sea mínima.».
El físico HERACLITUS concluyó de sus observaciones del medio ambiente que “todo fluye – nada permanece. En la naturaleza viva la creación y muerte son bien conocidas; en la materia inanimada también actúan fuerzas las cuales, en mayor o menor grado, cambian las cosas en nuestro alrededor:
• El pan se seca. • La mantequilla o grasas se rancian.
• El papel se vuelve. • El caucho se vuelve quebradizo, amarillento.
• El hierro se oxida. • El cobre se cubre de pátina.
• Las rocas se erosionan. • La arcilla se vuelve roca, etc.
Se podrían considerar efectos externos como la causa. Por ejemplo: el hierro no se oxidaría si se mantuviese aislado del oxígeno – sin embargo éste no es el punto, ya que sustancias aisladas del medio ambiente cambian.
Características de los potenciales químicos:
Ø La tendencia de una sustancia a:
· Reaccionar con otras sustancias
· Transformarse en otro estado
· Redistribuirse especialmente puede ser expresada por una única cantidad
· su potencial químico μ
Ø La magnitud de ésta tendencia, es decir el valor numérico de μ, puede variar y es determinado por:
· El tipo de sustancia
· El medio en el cual se encuentra pero no por el tipo de participantes en la reacción, ni por los productos que resulten.
Ø Una reacción, transformación, redistribución, etc. puede darse espontáneamente, cuando la tendencia hacia el proceso, sea más pronunciada en el estado inicial, que en el final.
Ejemplo: la combustión en una vela obedece a que las sustancias iniciales (en este caso parafina de fórmula ≈ CH2 y oxígeno de la atmósfera) tienen un potencial químico mayor que los productos finales (en este caso, dióxido de carbono y vapor de agua), esto es:
3 µ(O2) + 2 µ((CH2) > 2 µ(CO2) + 2 µ(H2O)
Valores
normales de los potenciales, para algunas sustancias comunes:
Sustancia
|
Fórmula
|
μ⊖
kG
|
Sustancias puras
|
||
Hierro
|
Fe|s
|
0
|
Grafito
|
C|grafito
|
0
|
Diamante
|
C|diamante
|
+3
|
Agua
|
H2O|l
|
-237
|
Vapor
de agua
|
H2O|g
|
-229
|
Sal
de cocina
|
NaCl|s
|
-384
|
Cuarzo
|
SiO2|s
|
-856
|
Mármol
|
CaCO3|s
|
-1129
|
Azúcar
de caña
|
C12H22O11|s
|
-1558
|
Parafina
|
≈(CH2)|s
|
+4
|
Benceno
|
C6H6|l
|
+125
|
Acetileno
|
C2H2|g
|
+210
|
En agua
|
||
Azúcar
|
C12H22O11|a
|
-1565
|
Amoníaco
|
NH3|a
|
-27
|
Hidrógeno
(I)
|
H+|a
|
0
|
Calcio(II)
|
Ca2+|a
|
-554
|
Las
sustancias elegidas en la tabla indican que no sólo se habla de potenciales
químicos cuando se trata de sustancias químicas bien definidas, sino también
cuando se habla de sustancias cotidianas.
La
condición previa para especificar el valor del potencial μ de una sustancia, es conocer la fórmula
química, la cual indica su composición y es requerida para todos los cálculos.
Por ésta razón esta fórmula no debe faltar en este tipo de tablas. Sin embargo
el valor del potencial químico de una sustancia pura también depende de su
estado de agregación, de su estructura cristalina etc. Por ejemplo, el agua
líquida y el vapor de agua, así como el diamante y el grafito tienen diferentes
potenciales químicos a la misma temperatura y presión. Para que los valores
de μ sean indicados inequívocamente
respecto al estado de agregación de una sustancia dada, se debería adicionar
|s, |l, |g, a las fórmulas. Las modificaciones pueden ser descritas por medio
del correspondiente nombre como grafito, diamante etc.
μ⊖
= μ(p⊖, T⊖)
para sustancias puras T⊖
= 298,15 K
μ⊖
= μ(p⊖, T⊖, c⊖) para sustancias disueltas p⊖ = 100 kPa
c⊖ =
1 kmol⋅m-
T⊖, p⊖, c⊖ se refieren a temperatura normal, presión
normal y concentración normal.
Potenciales estándar de
reducción
La diferencia de potencial entre el
ánodo y el cátodo, se denomina potencial de celda E0celda y coincide con la FEM.
El potencial de celda, E0celda,
de una celda galvánica siempre será positivo. Esto coincide con lo que decíamos
en un principio, la reacción redox debe ser una reacción es espontánea, para
que se genere una celda galvánica.
Por ejemplo:
Zn(s) + Cu+2(ac) → Zn+2(ac) + Cu(s) E0(celda)= 1,10 V Reacción, espontánea
Cu(s) + 2H+(ac) → H2 (g) + Cu+2(ac) E0(celda)= - 0,344 Reacción, No espontánea
Zn(s) + Cu+2(ac) → Zn+2(ac) + Cu(s) E0(celda)= 1,10 V Reacción, espontánea
Cu(s) + 2H+(ac) → H2 (g) + Cu+2(ac) E0(celda)= - 0,344 Reacción, No espontánea
Queda claro, que el potencial
de celda (E0celda), depende de las dos medias celdas:
catódica y anódica.
E0Celda=
E0oxidación - E0reducción
Por lo tanto, es necesario
determinar el potencial de celda de cada uno de los electrodos. Sin embargo no
se puede medir el potencial de un electrodo aislado. Para poder medir el
potencial de un solo electrodo, se diseño el Electrodo Estándar de Hidrógeno
(EEH).
Un EEH se compone de un electrodo
inerte de platino encerrado en un tubo de vidrio de modo que se pueda burbujear
hidrógeno gaseoso sobre el platino, y la solución contiene H+ en
condiciones estándar (1 M).
El electrodo estándar de hidrógeno,
EEH, fue diseñado y se le asignó arbitrariamente el valor de potencial igual a
cero, en el ocurre la siguiente reacción:
2H+(1M) + 2 e- → H2 (1 atm) E0(H+/H2) = 0,0 V
2H+(1M) + 2 e- → H2 (1 atm) E0(H+/H2) = 0,0 V
Se construyen las pilas voltaicas,
donde uno de los electrodos es el EEH, de tal manera que la medida del E0celda,
nos dé el valor del otro electrodo.
Notación abreviada:
Pt (s) / H2 (g, 1atm), H+ (ac, 1M) // Cu2+ (ac, 1M) / Cu (s)
Pt (s) / H2 (g, 1atm), H+ (ac, 1M) // Cu2+ (ac, 1M) / Cu (s)
Las medias reacciones serían:
Ánodo:
H2(g) → 2H+(ac) + 2e-
E0(oxidación) = 0,0V
Cátodo:
Cu+2(ac) + 2 e- → Cu(s) E0 (reducción) =
???
Se mide el voltaje de la celda:
E0Celda=
0,34
V
Teniendo en cuenta que e
E0 Celda =
E0 oxidación + E0 reducción
Podemos concluir que el E0
de reducción, E0(Cu+2/ Cu) = 0,34 V
Ahora hagamos el análisis,
colocando el EEH en el cátodo.
La celda voltaica, emplea un EEH y
un electrodo estándar de Zn2+/Zn. La reacción espontánea es la
oxidación del Zn y la reducción del H+:
Zn (s) + 2H+ (ac) → Zn2+ (ac) + H2 (g)
Zn (s) + 2H+ (ac) → Zn2+ (ac) + H2 (g)
Normalmente las tablas de
potenciales estándar se reportan como E0reducción .
Los valores E0oxidación tienen
la misma magnitud, pero con signo contrario, y corresponden a la reacción
inversa.
La
siguiente tabla incluye algunos Potenciales Estándar de Reducción a 25ºC, a los
que se les suele llamar potenciales de media celda, y se pueden combinar para
calcular las fem de una gran variedad de celdas voltaicas.
Tabla de potenciales
estándares
de reducción (25°C, 101kPa, 1M)
de reducción (25°C, 101kPa, 1M)
Semireacción de reducción
en el cátodo |
Potenciales
E0 (volts) |
Li+(aq) + e- ® Li(s)
|
-3.04
|
K+(aq) + e- ® K(s)
|
-2.92
|
Ca2+(aq) + 2e- ® Ca(s)
|
-2.76
|
Na+(aq) + e- ® Na(s)
|
-2.71
|
Mg2+(aq) + 2e- ® Mg(s)
|
-2.38
|
Al3+(aq) + 3e- ® Al(s)
|
-1.66
|
2H2O(l) + 2e- ® H2(g) + 2OH-(aq)
|
-0.83
|
Zn2+(aq) + 2e- ® Zn(s)
|
-0.76
|
Cr3+(aq) + 3e- ® Cr(s)
|
-0.74
|
Fe2+(aq) + 2e- ® Fe(s)
|
-0.41
|
Cd2+(aq) + 2e- ® Cd(s)
|
-0.40
|
Ni2+(aq) + 2e- ® Ni(s)
|
-0.23
|
Sn2+(aq) + 2e- ® Sn(s)
|
-0.14
|
Pb2+(aq) + 2e- ® Pb(s)
|
-0.13
|
Fe3+(aq) + 3e- ® Fe(s)
|
-0.04
|
2H+(aq) + 2e- ® H2(g)
|
0.00
|
Sn4+(aq) + 2e- ® Sn2+(aq)
|
0.15
|
Cu2+(aq) + e- ® Cu+(aq)
|
0.16
|
ClO4-(aq) + H2O(l) + 2e- ® ClO3-(aq) + 2OH-(aq)
|
0.17
|
AgCl(s) + e- ® Ag(s) + Cl-(aq)
|
0.22
|
Cu2+(aq) + 2e- ® Cu(s)
|
0.34
|
ClO3-(aq) + H2O(l) + 2e- ® ClO2-(aq) + 2OH-(aq)
|
0.35
|
IO-(aq) + H2O(l) + 2e- ® I-(aq) + 2OH-(aq)
|
0.49
|
Cu+(aq) + e- ® Cu(s)
|
0.52
|
I2(s) + 2e- ® 2I-(aq)
|
0.54
|
ClO2-(aq) + H2O(l) + 2e- ® ClO-(aq) + 2OH-(aq)
|
0.59
|
Fe3+(aq) + e- ® Fe2+(aq)
|
0.77
|
Hg22+(aq) + 2e- ® 2Hg(l)
|
0.80
|
Ag+(aq) + e- ® Ag(s)
|
0.80
|
Hg2+(aq) + 2e- ® Hg(l)
|
0.85
|
ClO-(aq) + H2O(l) + 2e- ® Cl-(aq) + 2OH-(aq)
|
0.90
|
2Hg2+(aq) + 2e- ® Hg22+(aq)
|
0.90
|
NO3-(aq) + 4H+(aq) + 3e- ® NO(g) + 2H2O(l)
|
0.96
|
Br2(l) + 2e- ® 2Br-(aq)
|
1.07
|
O2(g) + 4H+(aq) + 4e- ® 2H2O(l)
|
1.23
|
Cr2O72-(aq) + 14H+(aq) + 6e- ® 2Cr3+(aq) + 7H2O(l)
|
1.33
|
Cl2(g) + 2e- ® 2Cl-(aq)
|
1.36
|
Ce4+(aq) + e- ® Ce3+(aq)
|
1.44
|
MnO4-(aq) + 8H+(aq) + 5e- ® Mn2+(aq) + 4H2O(l)
|
1.49
|
H2O2(aq) + 2H+(aq) + 2e- ® 2H2O(l)
|
1.78
|
Co3+(aq) + e- ® Co2+(aq)
|
1.82
|
S2O82-(aq) + 2e- ® 2SO42-(aq)
|
2.01
|
O3(g) + 2H+(aq) + 2e- ® O2(g) + H2O(l)
|
2.07
|
F2(g) + 2e- ® 2F-(aq)
|
2.87
|





